Acqua e birra: lezioni di chimica
Ultimamente stiamo parlando di acqua. E sto spingendo molto, qui e altrove, sull’importanza di questo ingrediente nel processo produttivo.
Negli scorsi articoli ho parlato dando per scontate molte cose che alcuni di voi magari sanno, altri no. Oggi perciò non vorrei parlare strettamente di birra in quanto tale, piuttosto di chimica di base e, in particolare, di chimica dell’acqua. I concetti qui espressi ci saranno utili poi, lungo tutto il nostro percorso.
Cercherò di farla il più semplice possibile, ma voi promettetemi di leggere tutto da cima a fondo. Magari anche in più riprese, per assimilare meglio i concetti.
Ci tengo a precisare che non sono un chimico o tantomeno uno scienziato. La laurea (incorniciata ma schiaffata chissà dove) ce l’ho in lettere. Nel mio percorso ho approfondito inoltre arte, storia, informatica, filosofia, linguistica e latino. Insomma, tutta roba che non c’entra un tubo con la chimica. Perciò prendete quanto scrivo qui non come dogma assoluto. Felicissimo di eventuali precisazioni, appunti od obiezioni.
Cominciamo.
L’atomo e la tavola periodica
L’atomo (ά-τομοσ=indivisibile) è l’unità elementare che forma la materia dell’universo. Tutta.
Esso è costituito da:
- Un nucleo, fatto di particelle dette nucleoni che possono essere: o protoni, carichi positivamente, o neutroni, di carica nulla. L’idrogeno, invece, fa storia a sè perchè possiede di solito un protone ma nessun neutrone;
- Gli elettroni, particelle che “ruotano” (per così dire) attorno al nucleo su traiettorie predefinite (da 1 a 7). Queste traiettorie, dette comunemente orbite, hanno differente energia a seconda della loro lontananza dal nucleo: maggiore distanza da esso indica maggiore energia e dunque minore stabilità. Gli elettroni sono particelle cariche negativamente e sono generalmente in quantità uguale al numero di protoni, per bilanciare la carica complessiva.
La materia è formata da atomi di tipo diverso, chiamati specie chimiche o elementi. Gli atomi di specie chimiche differenti vengono distinti in base ai protoni che li costituiscono. il Calcio ha 20 protoni, il Magnesio 12… e via discorrendo.
C’è una tabella, la Tavola Periodica, che raggruppa gli elementi chimici conosciuti.

Approfondimento: Numero atomico e massa atomica
Abbiamo parlato di elementi, ma questi in natura si possono presentare sotto forme diverse. Esse vengono dette isotopi di un elemento ( ἴσος-τόπος=stesso posto) e hanno lo stesso numero di protoni, ma uno diverso di Neutroni. Dunque hanno lo stesso numero atomico ma un numero di massa (massa atomica) differente.
Il numero atomico è un numero presente nella tavola periodica ed è dato dal numero di protoni presenti nell’atomo di un elemento. Ad esempio un elemento come il già citato Calcio, visto che possiede 20 protoni, ha numero atomico 20.
Mentre il numero di massa è un numero che considera sia il numero dei protoni (numero atomico) sia quello dei neutroni. A differenza del numero atomico, esso è un decimale perchè si ricava tramite una media aritmetica della massa atomica degli isotopi che l’elemento in questione presenta. Ma queste cose a noi interessano solo di riflesso.
Molecole e composti
Nella vita di tutti i giorni gli atomi non sono entità a sè stanti, bensì sono uniti da particolari legami ad altri atomi. Questi atomi così legati tra loro costituiscono gruppi di atomi più complessi con caratteristiche specifiche, detti molecole.
Le molecole, a voler essere puntigliosi, non sono da confondere coi composti. Infatti esistono due tipi di molecole: semplici e composte. Le prime sono formate da più atomi dello stesso elemento legati tra loro. Un esempio tra tutti: O2. Una molecola composta è invece formata da più atomi di elementi diversi, legati ovviamente tra di loro. Il Cloruro di Sodio (NaCl), è un esempio di composto.
Anche le molecole e i composti hanno una massa molecolare che è, semplicemente, la somma dei pesi atomici dei diversi atomi costituenti.
L’acqua
Finito questo necessario quanto oberoso pistolozzo introduttivo parliamo di ciò che più ci interessa: l’acqua.
Essa è una molecola S-T-R-A-O-R-D-I-N-A-R-I-A, le cui caratteristiche sono tutt’oggi oggetto di studio perché, udite udite, molto probabilmente non sono state ancora comprese appieno.
L’acqua è composta da due atomi di Idrogeno e da un atomo di Ossigeno.
H2O
Nella molecola di acqua i tre atomi costituenti si dispongono a triangolo: l’ossigeno sta al centro, formando un vertice, l’idrogeno (ai suoi lati, in maniera simmetrica) forma gli altri due. In una molecola di acqua isolata e allo stato liquido l’angolo tra i due atomi di Idrogeno è perciò di 104,45°. Questa disposizione condiziona sensibilmente le caratteristiche elettriche e chimico-fisiche dell’acqua.
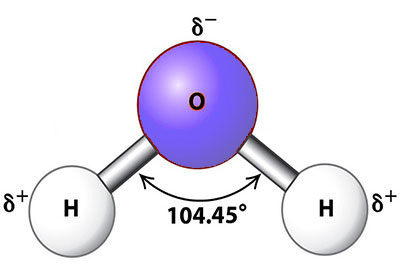
L’acqua come di-polo
In una molecola d’acqua l’atomo di Ossigeno, a causa della sua affinità elettronica, ha maggior forza rispetto all’idrogeno nell’attirare gli elettroni della molecola d’acqua nel suo insieme. In altre parole tutti gli elettroni presenti nel composto H2O (sia quelli di O che di H2) stazionano più tempo in prossimità del nucleo di ossigeno.
Il principio base è che se un atomo è ben compensato (o neutralizzato, per dirla in chimichese) le cariche positive e negative sono in equilibrio tra loro e, di conseguenza, questo sarà meno propenso ad attirare (esattamente come una calamita) cariche di altre molecole. Essendo gli elettroni del composto H2O più dalla parte dell’ossigeno, il suddetto composto avrà una carica elettrica non uniforme.
Tutto ciò si traduce nel fatto che il composto H2O, anche se nel complesso conserva una neutralità di carica, avrà due estremità: quella in prossimità dell’ossigeno, più negativa; quella dell’idrogeno, invece, maggiormente positiva. Capirete perché dunque si dice che l’acqua è una molecola polare. Per essere più precisi affrmiamo che è un molecola dipolare, cioè dotata di due poli.
Tutto ciò determina parecchie caratteristiche molto interessanti da un punto di vista chimico-fisico e, non da ultimo, biologico.
Primo e più importante aspetto è il legame idrogeno. Come è facile intuire da ciò che abbiamo detto sopra, ci sono forze di coesione tra le stesse molecole di acqua. Semplificando di molto diciamo che queste forze contribuiscono cioè a tenere unite le molecole di H2O come segue: il polo dell’idrogeno (e ne esistono due), che è lievemente positivo, si lega a quello dell’ossigeno di un’altra molecola d’acqua, lievemente negativo. Tutto ciò si riflette (tra le altre cose) sulla tensione superficiale dell’acqua, altra peculiarità molto interessante.
Potremmo poi stare ore a discutere di tutte le caratteristiche dell’acqua ma vi voglio bene e ve ne sparo subito soltanto un’altra: la capacità di scindere una serie di composti negli elementi che li costituiscono, cioè gli ioni.
Gli Ioni
Gli atomi non sono tutti neutrali. Cioè molti elementi non hanno di preferenza pari numero di protoni ed elettroni. Questo perché gli atomi possono acquisire o cedere elettroni. Ogni atomo (o molecola) a seconda delle caratteristiche strutturali, ha la possibilità di scambiare uno o più elettroni. A seconda del caso, dunque, gli elementi possono avere carica positiva o negativa.
Chiamiamo Cationi gli atomi dotati di carica elettrica positiva, Anioni quelli negativi.
Approfondiamo con ciò il concetto di ione: un’entità molecolare carica (positivamente o negativamente) che deriva dalla cessione o dall’acquisto di uno o più elettroni da parte di uno o più atomi o molecole.
Gli ioni sono solitamente trascritti come l’elemento costituente cui segue una serie di segni positivi o negativi pari al numero di elettroni scambiati.
Alcuni esempi: Il Sodio è un catione (Na+), come il magnesio (Mg++); nentre il Solfato è l’anione SO4- –
… e così via.
Persino l’acqua è in parte dissociata in ioni:
- il catione Idrogeno H+;
- l’anione Ossidrile OH- .
Mettendola così, è bene riflettere che l’idrogeno in acqua è dunque tendenzialmente solo un protone, essendo privato dell’unico elettrone in suo possesso.
Approfondimento sullo ione: Acido e Base
Un acido è una sostanza in grado di cedere uno o più ioni Idrogeno (H+) i quali sono, a loro volta, accettati da una base. La base, di conseguenza, è una sostanza capace di ricevere uno o più ioni Idrogeno ceduti da un acido.
La natura è economica e tende al minimo sforzo possibile.
Dunque una struttura atomica tende ad essere stabile, perché conserva maggiore energia. Di qui la pericolosità di sostanze più aggressive che tendono ad alterare la natura e la materia agendo sugli ioni H+, cioè scambiandoli tra i suoi costituenti e dunque rendendoli temporaneamente instabili. Gli acidi e le basi modificano, in sostanza, le caratteristiche elettriche della materia. E noi birrai ne usiamo quotidianamente quando birrifichiamo. Ad esempio la soda caustica (formula bruta: NaOH), è una base. Il peracetico, invece, un acido (CH3COOOH). Per l’uso oculato di questi due prodotti vi rimando all’apposita guida.
I sali
Possiamo definire sali quelle molecole composte formate da atomi che stanno insieme per attrazione elettrochimica. In genere si dividono in due parti: una acida e una basica. Pensatela un po’ come la calamita di cui prima: ciò che si muove (viene acquisito/ceduto) è l’elettrone (carica negativa). Visto che, sempre per quanto detto prima, una molecola che ha perso elettroni (ed è positiva [+]) così com’è tenderebbe ad essere meno stabile, si lega ad un’altra molecola negativa [-].
Un sale, visto da questa prospettiva, non è altro che due o più ioni uniti tra loro. Ioni che tendono a bilanciare le proprie cariche (carica neutra) per fare il miunor sofrzo possibile.
Quanto appena detto sarà molto importante anche quando andremo a formulare la composizione chimica della nostra acqua di birrificazione: dovremo studiare un soluto le cui cariche, in linea generale, si bilancino tra loro.
Per capire infine il concetto di sale, facciamo qualche esempio base di sali utilizzati comunemente da noi homebrewers per remineralizzare l’acqua:
- In solfato di magnesio non è altro che l’unione del catione solfato (SO4- -) con l’anione magnesio (Mg+ +);
- Il solfato di calcio è anione solfato (SO4- -) unito al catione calcio (Ca+ +);
- Il cloruro di calcio è anione cloro (Cl-) più catione calcio (Ca+ +).
Nell’ultimo esempio si può notare come il calcio presenti due cariche positive e il cloro solo una. Dunque nello specifico, per bilanciare l’equazione, il cloruro di calcio conterrà un catione Ca + + e due anioni Cl -.
I legami che uniscono questi due estremi i cui esempi sono stati analizzati, sono detti legami ionici. Essi sono legami che, tuttavia, non sono molto vincolati, anzi risultano alquanto deboli. Per nostra fortuna, aggiungerei, perché in questo modo possono essere scissi con facilità dall’acqua.
L’acqua, un buon solvente
Sciogliendo i sali all’interno dell’acqua noi non facciamo altro che andare a separarli nelle sue due (o più) costituenti. Essendo, come abbiamo detto prima, l’acqua una molecola polare, andrà ad attirare e “circondare” i vari ioni (anioni e cationi) che compongono il sale. Questo sistema perfetto permette di veicolare nutrimento minerale per gli organismi che stanno alla base della scala evolutiva: organismi detti autotrofi quali piante, cianobatteri e simili. Perché? Perché i nutrienti sono separati dalle molecole di acqua e dunque disciolti in essa.
Dicendo disciolto utilizzo l’accezione propria del termine in quanto la molecola d’acqua, per via delle sue ridotte dimensioni, si insinua tra gli ioni del sale e li circonda, isolandoli dagli altri. Entra in gioco, oltre ad un parametro fisico, anche uno chimico: l’acqua come di-polo si lega ai costituenti (ioni) del sale così isolati.
Differenti caratteristiche chimico-fisiche-elettriche delle molecole così solute determinano la quantità massima di sale che è possibile mettere in soluzione in una determinata quantità di acqua, detta concentrazione.
Parliamo di concentrazione di un composto (in acqua) la grandezza che ci dice il rapporto tra la quantità del componente in oggetto (un sale, nel nostro caso) e la quantità totale di tutti i composti che formano la nostra soluzione.
Non tutte le sostanze possono essere però disciolte in acqua. Tra queste, ad esempio, troviamo lo zucchero (C12H22O11), grassi ed oli. Essi hanno la particolarità di non essere polari come gli ioni. Perché? Perché la natura è taccagna (l’avete capito?) e trova più conveniente formare nuovi legami idrogeno all’interno dell’acqua stessa piuttosto che scindere composti non polari, cosa che costerebbe molta fatica.
Abbiamo poco fa parlato di Soluzione. Parola già introdotta nell’articolo sulle membrane osmotiche.
Si dice soluzione un tipo di miscela in cui un elemento allo stato fisico liquido (per noi l’acqua) è quello maggiore nel quale sono miscelati degli altri elementi che in esso si dissolvono.
Una soluzione è perciò composta da un solvente, propriamente ciò in cui si di-scioglie(=acqua), e un soluto, ciò che viene di-sciolto (=sali). Questi ultimi si possono presentare sia sotto forma di ioni (=ionica), che come molecole (=molecolare) (uno zucchero, ad esempio).
La soluzione così risultante si presenta in genere indistinguibile nelle sue componenti (soluto e solvente) ad occhio nudo o tramite l’aiuto di un microscopio, a patto che non si superi la soglia di solubilità che è, in sostanza, la quantità massima di soluto che possiamo sciogliere in un determinato solvente. Solitamente si è soliti accompagnare i dati sulla solubilità in acqua alla temperatura di quest’ultima. Poi esistono determinati soluti (come il bicarbonato di calcio) che aumentano la propria solubilità anche in funzione dell’anidride carbonica disciolta per una serie di motivi che spiegherò più avanti, in un futuro articolo sui carbonati.
Spesso si parla di soluzione satura o insatura. Una soluzione satura ha, semplicemente, raggiunto la sua soglia di solubilità. Quella insatura, al contrario, no.

ppm e mg/l
Finiamo parlando di concentrazione. Questa grandezza è esprimibile attraverso un’unità di misura che definisce il rapporto tra solvente e soluto e ci indica, nello specifico, quante molecole di un determinato tipo troviamo, nel nostro caso, disciolte in acqua.
Esistono più unità di misura per indicare la concentrazione:
- Si parte da standard più funzionali a livello chimico come la molarità (mole su volume, M/V), la molalità (mole/peso, M/P), la normalità (equivalenti/volume, E/V);
- passando attraverso standard più legati a peso e volume come il volume/volume (V/V), peso/volume (P/V), peso/peso (P/P).
Noi siamo più interessati agli standard funzionali che si basano sul peso, dunque i secondi. Solitamente nel nostro ambito si usano i milligrammi su litro, mg/l, o le parti per milione, ppm.
I primi esprimono la concentrazione su peso/volume. Questo è un rapporto tra due grandezze non omogenee, cioè che non si riferiscono alla stessa dimensione e dunque non sono direttamente confrontabili tra loro.
Le seconde, invece, si riferiscono ai mg/Kg. In poche parole una parte per milione è un milligrammo su chilogrammo e dunque è uno standard P/P.
Da quanto detto si evince facilmente che 1 parte per milione (ppm) non equivale ad 1 milligrammo su litro (mg/l), poichè le due unità di grandezza non sono direttamente confrontabili. Possiamo confrontarle sì, ma solo in presenza di un fattore di conversione. Nella pratica di tutti i giorni, tuttavia, noi birrai utilizziamo le ppm come sinonimo di mg/l. Perché?
Perché l’acqua in condizioni standard è pressoché uguale in queste due unità di misura. In acqua pura a temperatura di 4°C, cioè, un litro di H2O pesa 999,972 grammi, quasi 1 Kg.
Ad essere pignoli, purtuttavia, dovremmo dire che un qualsiasi profilo di partenza di una qualsiasi acqua destinata alla birrificazione non possiede le condizioni definite (in chimichese) “standard” dell’acqua.
Qual’è, ciò detto, l’unità di misura formalmente corretta parlando di acqua e birra? Ovviamente i mg/l. Perché? Perchè ci riferiamo a concentrazioni saline (meglio, di ioni), quantificabili più facilmente come peso, sciolte in acqua, generalmente misurata in volume.
Ma voi mi sentirete lo stesso parlare di ppm, perché tutti fanno così ed è molto più comprensibile a tutti.
Ho finito… Per oggi.





